Обобщающее
повторение по теме: «Соединения химических
элементов».
Цель урока: обобщить знания учащихся
по теме сложные вещества.
Задачи урока:
- повторить и обобщить материал о составе
веществ, относящихся к основным классам
неорганических веществ;
- закрепить знания учащихся по составлению
формулы;
- закрепить знания учащихся по номенклатуре
основных классов неорганических веществ;
- развивать навыки работы в группе
Тип урока: повторительно-обобщающий
Структура урока:
Организационный момент
Вступительное слово учителя /сообщение
темы, целеполагание, план урока,
мотивация/
Выполнение учащимися индивидуально/коллективно
различного рода заданий обобщающего
и систематизирующего характера,
вырабатывающих обобщённые умения,
формирующих обобщённо- понятийные
знания
Проверка выполнения работ, корректировка
/при необходимости/
Формулирование выводов по материалу
Оценка результатов урока
Подведение итогов
Задание на дом /индивидуально на основе
работы на уроке/.
Форма работы – групповая.
Ход урока:
Сегодняшний наш урок является завершающим
по теме и то, насколько хорошо сегодня
будем работать, настолько хорошо
подготовимся к выполнению контрольной
работы на следующем уроке. Чтобы вам
было интереснее, будем работать в
группах, которые станут командами,
стремящимися получить приз, а приз- это
ВАШИ систематизированные знания. Каждая
из ваших команд будет иметь помощника-
компьютер. Тема, которую нам предстоит
повторить, «Соединения химических
элементов». Для начала плодотворной
работы немного загадок, которые помогут
вам при выполнении следующего задания:
1. Хлориды и нитраты,
Сульфаты, карбонаты.
Я без труда и боли
Объединю в класс. . . (Соли).
2. Они имеют кислый вкус,
В них изменяет цвет и лакмус,
А
если активный металл попадет,
Получим мы соль и еще водород. (Кислоты).
3. Их получают путем горения,
Или сложных веществ разложением.
В них два элемента, один – кислород.
Я отнесу к ним и известь и лед.
(Оксиды).
АВТОР НЕИЗВЕСТЕН.
Загадки про индикаторы
Смущает меня щелочная среда;
Краснею...
Но если вокруг кислота,
И если в воде
растворен я один,
Не видно меня. Я -
... (фенолфталеин)
Ах, что же я
поделаю с собой -
Ведь в щелочи я
сине-голубой.
А в кислоте быть синим
я не смею:
Я - ... в кислотах я краснею.
(лакмус)
Как на прогулке от мороза,
От кислого я стану розов.
Но вид
мой в щелочи смешон:
Я сразу желтый,
как лимон. (метиловый оранжевый)
ЗАГАДКИ (про индикаторы) ПО МАТЕРИАЛАМ
САЙТА: http://www.alhimik.ru/fun/fun35.html
Теперь, чтобы легче было «играть в
химический морской бой», каждая из групп
получает задание - составить схему
классификации веществ (смотри приложение
«Вещества»). После этого организуется
проверка и, как дополнение, вопросы,
касающиеся определений основных классов
неорганических веществ.
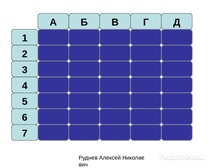
После этого морской бой (слайд 2)-
суть игры ничем не отличается от
привычной, но в клетках не корабли, а
формулы веществ (надо дать названия),
либо названия (надо составить формулу).
Игра ведётся до определённого учителем
(в зависимости от уровня подготовки
класса) балла. Общую «картину битвы»
можно вывести при помощи проектора на
доску.
Сейчас подробнее поговорим о веществах,
которые мы используем в быту (чаще
кулинария), без которых (одного из
представителей) невозможен нормальный
процесс пищеварения человека - о кислотах.
Что мы о них знаем, какие принципы
классификации кислот известны, каковы
правила Т.Б. при работе с кислотами?
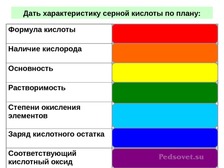
Очень важной и распространённой кислотой
является серная - на её примере разберём
характеристику кислот (слайд 3- а
какого цвета из этой радужной палитры
станут различные индикаторы в растворе
серной кислоты, напомните мне?!))-
совместная работа. А как правильно
разбавлять кислоту? /Сначала вода, потом
кислота - иначе случится большая беда!/.
Затем каждая из групп (либо индивидуально)
получает задание: характеристика кислоты
по плану, /например фосфорная и азотная/.
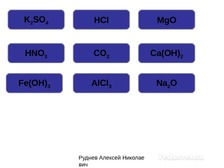
Конкурс капитанов /лидеров групп/:
блиц-опрос. Распределите по «домам»
следующие вещества /примерный перечень
веществ/ с обязательным разбором ошибок:
1 группа: K2SO4,
HCl,
MgO,
HNO3,
CO2,
Ca(OH)2,
Fe(OH)3,
AlCl3,
Na2O
– как пример оформления смотри презентацию
(слайд 4)
2 группа:
Fe2O3,
H2SO4,
Na3PO4,
ВаСI2,
Al(OH)3,
P2O5,
H3PO4,
CuCO3,
NaOH
3 группа:
MgSO4,
BaCl2,
N2O5,
HNO3,
K2O,
NaOH, CO2,
CaO, H2S
4 группа:
H2SO3;
Na2SO4;
Fe2O3;
HBr; HNO3;
Ca(OH)2;
SO2;
H2S;
NaCl.
5 группа:
Mg(ОН)2;;
BaSО4,
Nа2O,
HNO3,
Cu(OH)2,
NaOH, H2CO3,
Ba(OH)2,
H2S.
И последнее задание, в решении которого
группам предстоит продемонстрировать
знания о сложных веществах, применяемых
в быту и их тривиальных названиях:
Найдите по формулам веществ их название
в быту и определите области их применения,
одно из веществ вам пока неизвестно, но
попробуйте определить его методом
исключения.
|
Формула
|
Название
|
Область применения
|
|
Н2О
|
1. Негашеная известь
|
А. Его раствор воде
– нашатырный спирт
|
|
Са(ОН)2
|
2. Углекислый газ
|
Б. Под действием
углекислого газа мутнеет
|
|
NaCl
|
3. Пищевая или питьевая
сода
|
В. Желудочный сок
|
|
СО2
|
4. Вода
|
Г. Сухой лед
|
|
NаНСО3
|
5.
Поваренная соль
|
Д. В строительстве
|
|
NH3
|
6.
Хлороводород
|
Е. Консервирование
пищевых продуктов, необходимая добавка
в пищу
|
|
HCl
|
7. Гашеная известь,
известковая вода
|
Ж. При замерзании
расширяется
|
|
СаО
|
8.
Аммиак
|
З. Пищевая промышленность,
медицина
|
Ответ :
|
Н2О
|
4, Ж
|
1 балл
|
|
Са(ОН)2
|
7, Б
|
1 балл
|
|
NaCl
|
5, Е
|
1 балл
|
|
СО2
|
2, Г
|
1 балл
|
|
NаHСО3
|
3, З
|
1 балл
|
|
NH3
|
8, А
|
1 балл
|
|
HCl
|
6, В
|
1 балл
|
|
СаО
|
1, Д
|
1 балл
|
Проверка- обмен командами (группами)
бланков- ответов и взаимооценка работы
с последующим разбором характерных
ошибок.
Подведение итогов.
Сегодня на уроке вы показали знания
состава сложных веществ, умения их
классифицировать и распознавать,
определять области их применения. Работа
в группе многим из вас помогла в коррекции
знаний, в поиске правильного ответа.
Дома вам предстоит еще раз проанализировать
задания, выполненные на уроке, и
подготовиться к контрольной работе.
А теперь вместе оценим работу на уроке:
1. Анализ технологических карт урока;
2. Взаимооценка учащимися + оценка
«лидеров»;
3. Оценивание работы на уроке учителем.
Примечание:
Конкурс капитанов можно заменить (исходя
из времени и особенностей класса) на
флеш-игру (тренажёр) «Химическая защита»,
расположенную по адресу:
http://mirhim.ucoz.ru/load/flash_posobija/trenazhjor/khimicheskaja_zashhita/7-1-0-144
Технологическая карта урока:
|
Этап урока
|
Максимальный
балл
|
Набрано баллов
|
|
Загадки
|
6
|
|
|
Схема «Вещества»
|
6
|
|
|
Морской бой
|
10
|
|
|
Характеристика
кислот
|
7
|
|
|
Конкурс
капитанов
|
9
|
|
|
Химия в
быту
|
8
|
|
|
ИТОГО
|
46 – 100%
|
|
Если ты набрал более 36-46 баллов (80-100%),
то ты преодолел все трудности - молодец!
Если ты набрал 27-35 баллов (60-80%) – это
тоже очень хорошо!
Если у тебя 18-34 баллов (40-60%) – это тоже
неплохо, но тебе есть к чему стремиться!
Если же ты набрал менее 18 баллов, не
огорчайся! У тебя ещё не всё потеряно.
Тебе нужно ещё раз повторить данную
тему, твои знания ждут тебя впереди!