Методика определения зависимости электропроводности растворов сильных электролитов от концентрации: фрагмент урока и рекомендации учителя
На этапе ориентировочной деятельности создаются условия для возникновения проблемной ситуации, проводится количественный эксперимент с помощью датчиков ЦЛ, в ходе которого измеряется электропроводность растворов сильных электролитов от числа капель исследуемых электролитов.
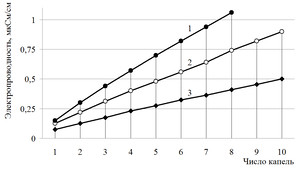
Школьникам предлагается сравнить графики электропроводности растворов хлоридов калия и алюминия и отметить различия. Сопоставляя графики электропроводности, учащиеся отмечают, что электропроводность в растворе хлорида алюминия возрастает быстрее, чем у хлорида калия (рис.1). Этот результат создает проблемную ситуацию. В результате школьники самостоятельно формулируют познавательную проблему: «Почему графики имеют разные углы наклона? Чем это можно объяснить?». Для разрешения проблемы выдвигается гипотеза, что увеличение электропроводности растворов сильных электролитов связано с увеличением концентрации заряженных частиц.
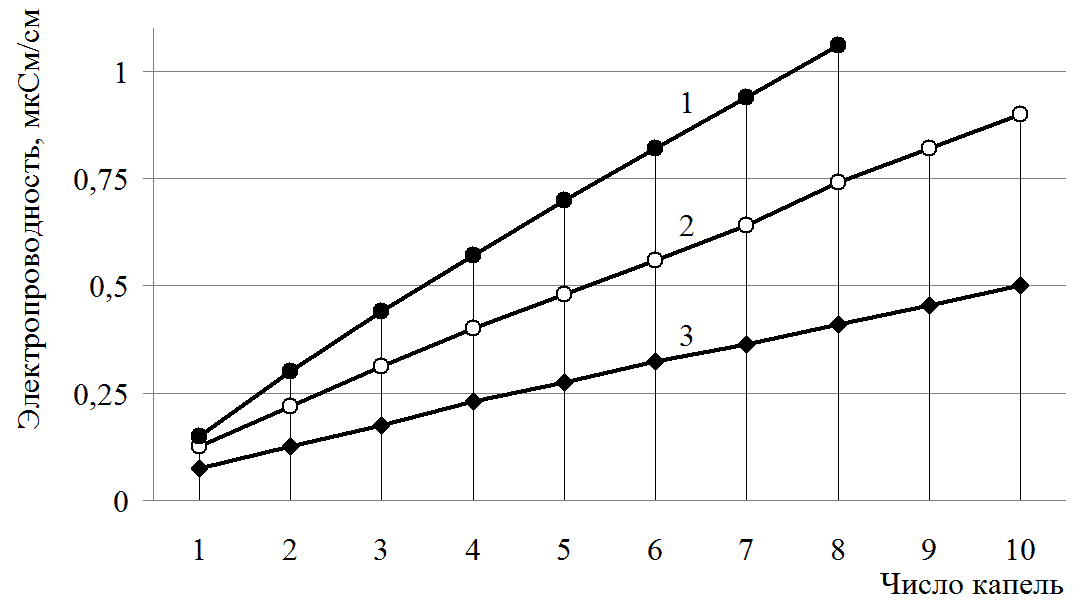
Зависимость электропроводности растворов от числа добавленных капель
1М растворов: 1 — AlCl3; 2 — MgCl2; 3 — КCl
На этапе исполнительской деятельности в форме самостоятельного совместного исследовательского эксперимента в малых группах сотрудничества учащиеся решают проблему, опираясь на имеющиеся знания, определяют число ионов при диссоциации, составляют уравнения диссоциации солей и объясняют сущность наблюдаемых явлений.
При проведении проверочного эксперимента (проверка правильности решения проблемы) по измерению электропроводности хлорида магния (нитрата алюминия, нитрата натрия и др.) учащиеся подтверждают правильные выводы. На этапе контрольно-оценочной деятельности школьники обсуждают результаты количественных экспериментов, полученных всеми группами, сравнивают графики и отвечают на предложенные вопросы.
Таким образом, решается проблема, связанная с объяснением экспериментальных фактов, устанавливается зависимость электропроводности сильных электролитов и числом (концентрацией) ионов, образующихся при диссоциации, что позволяет осознанно подойти к составлению уравнений электролитической диссоциации.
Цели урока
- Организовать деятельность учащихся по усвоению новых понятий об электролитах, неэлектролитах, электролитической диссоциации.
- Организовать деятельность учащихся по формированию умений: определять электропроводность растворов электролитов с помощью датчика электропроводности цифровой лаборатории SenseDisc Biochemistry.
- Установить взаимосвязь между электропроводностью и числом ионов, образующихся при диссоциации.
- Организовать деятельность учащихся по формированию умений: составлять уравнения электролитической диссоциации.
Оборудование и материалы
Цифровая лаборатория по химии и биологии — SenseDisс Biochemistry, датчик электропроводности; мерные цилиндры на 100 мл; магнитная мешалка (или стеклянная палочка); прибор для определения электропроводности; промывалка; стаканы на 200 мл — 5 штук; бюретка —5 штук; колбы мерные 100 мл — 5 штук; штативы химические; фильтровальная бумага; дистиллированная вода; 1М раствор хлорида калия; 1М раствор хлорида магния; 1М раствор хлорида алюминия; 1М раствор нитрата алюминия; 1М раствор нитрата натрия.
Структура урока
|
№ |
Дидактическая задача |
Содержание этапа |
Метод, форма |
|---|---|---|---|
|
I. Организационные моменты (1 мин) |
|||
|
I |
Психологически настроить учащихся на учебную деятельность. Организация рабочего места, правила ТБ |
Проверка наличия тетрадей, рабочих листов к уроку, наличия оборудования на рабочих местах. Повторение правил по технике безопасности при работе в кабинете химии |
Фронтальная форма организации работы.
|
|
II. Актуализация знаний (5 мин) |
|||
|
|
Актуализировать учебные знания и умения, мыслительные операции, необходимые для восприятия нового материала. 1. Актуализация знаний о значении электролитов, их роли в жизни и технике. 2. Повторение понятий: электролиты и неэлектролиты, 3. Мотивация учащихся на изучение нового материала |
Учитель организует деятельность учащихся по актуализации знаний учащихся, предлагает ответить на вопросы:
а) этилового спирта, б) хлорида калия; в) хлорида магния; г) хлорида алюминия Ученики отвечают на вопросы учителя. Учитель предлагает проверить электропроводность хлоридов калия, магния и алюминия. |
Фронтальная работа. Беседа. Совместная деятельность учитель- ученик Презентация POWER POINT |
|
III. Целеполагание (5 минут) |
|||
|
|
Подведение учащихся к определению дидактической цели урока. 1.Формулировка целей и задач урока: установить зависимость электропроводности сильных электролитов и числом (концентрацией) ионов, образующихся при диссоциации, 2. Обсуждение понятий: электрическое сопротивление, электропроводность. актуализировать известные учащимся из курса физики сведения об электрическом сопротивлении (R), единицах его измерения — омах (Ом). Также следует ввести понятие о физической величине, обратной сопротивлению, — электропроводности (электрической проводимости), которая, соответственно, измеряется в Ом–1 или сименсах (См).
|
Учитель демонстрирует электропроводность в предложенных растворах с помощью прибора для проверки на электропроводность. Возникает проблемный вопрос: свечение лампочки в растворах электролитов одинаково, однако, предложенные электролиты состоят из разного количества ионов и при диссоциации могут образовывать разное число ионов. Существуют ли методы количественного определения электропроводности? Учащиеся совместно с учителем формулирую цель: необходимо установить зависимость электропроводности электролитов и числом ионов, образующихся при диссоциации.
Учитель демонстрирует ЦЛ SenseDisc Biochemistry, датчик электропроводности. Обсуждает с учащимися понятия: электрическое сопротивление, удельная электропроводность, единицы измерения электропроводности. Электрической проводимостью (электропроводностью) называют способность вещества проводить электрический ток. В качестве количественной меры способности раствора электролита проводить электрический ток используют обычно удельную электропроводность κ (каппа):
где R — электрическое сопротивление проводника (Ом), длина которого l (м) и площадь поперечного сечения S (м2). Таким образом, единица измерения удельной электропроводности —
|
Фронтальная работа. Беседа Проблемный метод
Совместная деятельность учитель- ученик Презентация POWER POINT |
|
IV Изучение нового материала (10 минут)
|
|||
|
|
Обеспечить восприятие, осмысление первичного запоминания знаний и способов действий, связей и отношений в объекте изучения.
Задачи: а) измерить электропроводность разбавленных водных растворов сильных электролитов; б) установить взаимосвязь между электропроводностью и числом ионов, образующихся при диссоциации; в) проанализировать графики зависимости электропроводности растворов солей от числа капель электролитов. |
Учитель проводит демонстрационный количественный эксперимент с помощью датчика ЦЛ, в ходе которого измеряется электропроводность раствора сильного электролита хлорида калия от числа капель. График демонстрируются с помощью проектора на экране в режиме реального времени. Затем проводится аналогичный демонстрационный эксперимент по измерению электропроводности хлорида алюминия. Школьникам предлагается сравнить графики электропроводности растворов хлоридов калия и алюминия и отметить различия. Сопоставляя графики электропроводности, сравнивая угловые коэффициенты, учащиеся отмечают, что электропроводность в растворе хлорида алюминия возрастает быстрее (угловой коэффициент 0,9), чем у хлорида калия (угловой коэффициент 0,5). Этот результат создает проблемную ситуацию. В результате школьники самостоятельно формулируют познавательную проблему: «Почему графики имеют разные углы наклона? Чем это можно объяснить?» Для разрешения проблемы выдвигается гипотеза, что увеличение электропроводности растворов сильных электролитов связано с увеличением концентрации заряженных частиц, т. к. при диссоциации хлорида калия образуется два моль ионов, а при диссоциации хлорида алюминия — четыре моль ионов. Учитель предлагает ответить на вопрос: предположите, каким будет наклон графика 1М раствора сульфата алюминия? Учащиеся предполагают, что угол наклона будет еще больше, так ка при диссоциации образуется пять моль ионов.
|
Фронтальная работа. Беседа. Проблемный метод Совместная деятельность учитель-ученик Презентация POWER POINT Работа с ЦЛ - SenseDisс Biochemistr и датчиком электропроводности |
|
V. Совершенствование знаний, умений, навыков (12 минут)
|
|||
|
|
Фиксация полученных знаний при решении задач 1.Сформировать умения определять электропроводность с помощью датчика электропроводности. 2. Составлять графики зависимости электропроводности от числа капель. 3.Формировать умения делать выводы и объяснять результаты опытов и наблюдений на основе имеющихся знаний. 4. Формировать умения выявлять причинно-следственные связи.
|
Школьникам предлагается провести лабораторные опыты и измерить электропроводность в растворах хлорида магния (группа 1) и нитрата алюминия (группа 2) и ответить на поставленные вопросы (см. рабочий лист у уроку): Задание 1. Измерьте значения электропроводности в растворах электролитов Задание 2. Данные занесите в таблицу. Задание 3. Рассчитайте угловой коэффициент (тангенс угла наклона) Задание 4. Постройте графики зависимости значений электропроводности растворов от числа капель исследуемых электролитов и рассчитайте угловые коэффициенты. Задание 5. Напишите уравнения диссоциации исследуемых электролитов. Определите, какое количество ионов образуется при диссоциации 1 моль каждого электролита. Ученики выполняют лабораторные опыты в группах, фиксируют данные, заносят в таблицу рабочего листа и строят графики на миллиметровой бумаге. Отвечают на поставленные вопросы и заносят ответы в рабочие листы.
|
Лабораторные опыты учащихся. Парная работа и индивидуальная Частично-поисковый метод.
Совместная деятельность учитель-ученик Презентация POWER POINT Работа с ЦЛ - SenseDisс Biochemistr и датчиком электропроводности |
|
VI. Рефлексия (10 минут)
|
|||
|
|
Соотнесение поставленных задач с достигнутым результатом. 1.Закрепление знаний, коррекция, рефлексия. 2. Формировать умения делать выводы и объяснять результаты опытов и наблюдений на основе имеющихся знаний. 3.Формировать умения выявлять причинно-следственные связи. 4. Формировать умения объяснять экспериментальные факты и формулировать выводы.
|
На этапе контрольно-оценочной деятельности школьники обсуждают результаты количественных экспериментов, полученных всеми группами.
Учащиеся строят графики на доске, сравнивают и анализируют графики. Делают выводы, что угловой коэффициент графика электропроводности хлорида магния (образующего при диссоциации 3 моль ионов) относится к угловому коэффициенту графика электропроводности нитрата алюминия (образующего 4 моль ионов) относится как 3 к 4.
Ученики отвечают на поставленные вопросы и пишут уравнения электролитической диссоциации. 1.При полной диссоциации 1 моль нитрата цинка образуется: а) 3 моль катионов цинка и 1 моль нитрат-ионов; б)1 моль катионов цинка и 3 моль нитрат-ионов; в)2 моль катионов цинка и 3 моль нитрат-ионов г)1 моль катионов цинка и 2 моль нитрат-ионов 2. Наибольшее значение электропроводности можно ожидать, если добавить 7 капель 1М раствора: а) хлорида калия б) хлорида аммония в) хлорида магния г) фосфата натрия? 3. По графикам зависимости электропроводности от числа капель (см. рис. 1) , определите, формулы электролитов (хлорид калия, магния, алюминия). Рис. 1. Графики зависимости электропроводности электролитов от числа капель. Учащиеся сравнивают графики и отвечают на предложенные вопросы, формулируют выводы: при диссоциации электролита происходит увеличение числа заряженных частиц в растворе, что приводит к возрастанию электропроводности. Причем, чем больше концентрация ионов, тем выше электропроводность. Учитывая диссоциацию солей: MeCl → Me+ +Cl– образуются две частицы; MeCl2 → Me2+ + 2Cl– образуются три частицы; MeCl3 → Me3+ + 3Cl– образуются четыре частицы; Т.о. увеличение концентрации ионов в 1М растворах приводит к увеличению электропроводности.
|
Совместная деятельность учитель-ученик.
Проверка ответов на вопросы.
Метод упражнений.
|
|
Домашнее задание (1 мин) |
|||
|
|
Согласовать домашнее задание. |
|
|
Таким образом, решается проблема, связанная с объяснением экспериментальных фактов, устанавливается зависимость электропроводности сильных электролитов и числом (концентрацией) ионов, образующихся при диссоциации, что позволяет осознанно подойти к составлению уравнений электролитической диссоциации.
Использование цифровых лабораторий на уроке для получения количественных характеристик исследуемого явления и их интерпретация позволяет достичь более глубокого и осмысленного понимания изучаемых теоретических представлений.
Безусловно, цифровые лаборатории имеют существенные преимущества по сравнению с традиционными средствами обучения. Помимо уже рассмотренных выше, необходимо отметить следующие возможности, которые получает учитель, организующий познавательную деятельность школьников с использованием ЦЛ:
- визуализация данных повышает наглядность химического эксперимента, делает его более понятным, позволяет ученикам-исследователям скорее прийти к правильному решению;
- фиксация малых изменений, неочевидных в традиционном эксперименте, повышает качество учебного исследования;
- неоднократное повторение измерений позволяет ученикам выявить научный факт и соотнести его с изучаемой теорией.
Использование ЦЛ на уроке для получения количественных характеристик исследуемого явления и их интерпретация позволяет достичь более глубокого и осмысленного понимания изучаемых теоретических представлений.
Список литературы
- Учебное пособие. Использование цифровых лабораторий при обучении химии с средней школе/ авторский коллектив П.И.Беспалов, М.В.
- Дорофеев, Д.М.Жилин, А.И.Зимина, П.А.Оржековский. -М.: БИНОМ. Лаборатория Знаний, 2014. -229 с.
- Зимина А.И., Дорофеев М.В. Изучение теории электролитической диссоциации с использованием датчика электропроводности. // Актуальные проблемы химического образования: II Всероссийская научно-методическая конференция. Сборник материалов. — М.: МАКС Пресс, 2011. С. 88 – 91.
- Holmquist D.D., Randall J., Volz D.L. Conductivity of Solutions: The Effect of Concentration. // Chemistry with Vernier. P. 13 – 16. Доступно на сайте http://www.vernier.com
Кратко об авторе:
 Зимина Алла Ивановна — учитель химии, ГБОУ ШКОЛА №1287, кандидат педагогических наук, почетный работник образования г. Москвы; лауреат конкурса Грант Москвы в сфере образования; победитель конкурса лучших учителей в рамках национального проекта «Образование».
Зимина Алла Ивановна — учитель химии, ГБОУ ШКОЛА №1287, кандидат педагогических наук, почетный работник образования г. Москвы; лауреат конкурса Грант Москвы в сфере образования; победитель конкурса лучших учителей в рамках национального проекта «Образование».
Фото предоставлены автором.

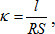
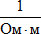 , однако, в химии используют величину
, однако, в химии используют величину 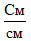 (сименс на сантиметр).
(сименс на сантиметр).