Б
ыкова
Татьяна Леонидовна, учитель химии.
Муниципальное
общеобразовательное учреждение
«Средняя
общеобразовательная школа №54»,
г.Барнаул, Алтайский
край.
Конкурс интерактивных
презентаций "Интерактивная мозаика".
Сообщество взаимопомощи
учителей http://pedsovet.su/
Инструкция
к
дидактическому материалу «Неорганические
кислоты»
П
ереход
на последний слайд по кнопке.
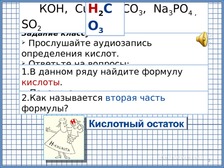
П
ри
нажатии на кнопку, учащиеся слушают
определение кислот, отвечают на вопросы,
при этом по щелчку выходят ответы.
Переход на следующий слайд по щелчку.
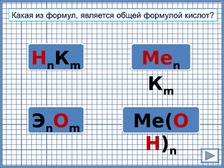
О
бозначены
общие формулы классов: оксиды, основания,
кислоты, соли. При щелчке на правильный
ответ - увеличивается в размере,
неправильные – выцветают (триггеры).
Переход на следующий слайд по кнопке.
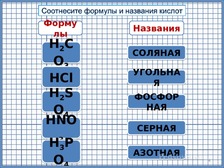
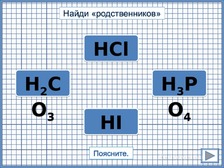
По
щелчку названия кислот располагаются
у соответствующих формул. Переход на
следующий слайд по щелчку.
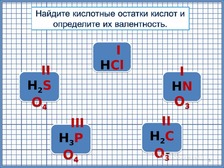
По
щелчку на формулы, появляются формулы,
с обозначенными кислотными остатками
и их валентностью. Переход на следующий
слайд по щелчку.
По
щелчку на формулы кислот, бескислородные
меняют цвет, кислородсодержащие
увеличиваются в размере (триггеры).
Переход на следующий слайд по кнопке.
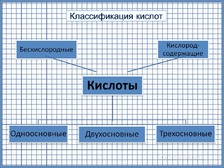
Слайд
№7.
Схема классификации кислот. Переход на
следующий слайд по щелчку.
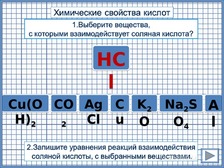
При
щелчке на формулы веществ, реагирующих
с НСl
– поднимаются на верх, не реагирующие
– вниз (триггеры). Переход на следующий
слайд по кнопке.
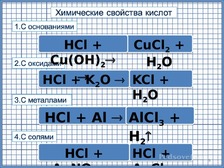
По
щелчку выходит правая часть уравнения
реакции и название химического свойства
кислот. Переход на следующий слайд по
щелчку.
При
нажатии на название химического свойства
кислот – переход на сайт, для просмотра
видеоопыта (гиперссылки). По щелчку
выходит уравнение реакции, соответствующего
видеоопыта. Переход на следующий слайд
по щелчку.
П
ереход
на первый слайд по кнопке.