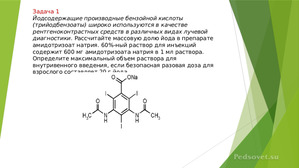
Слайд 6
Задача 3.Сколько тепла выделится при сжигании 50 л этилена (I) = Ar(I)/Mr(в-ва)н.у.), если теплоты образования этилена, воды и углекислого газа соответственно равны: -52,31 кДж/моль, 285,6 кДж/моль,393,5 кДж/моль. 1 Уравнение химической реакции C 2 H 4 + 3O 2 =2CO 2 + 2H 2 O Qобр.-52,31 0 393,5 285,6 кДж\мольобр.-52,31 0 393,5 285,6 кДж\моль 2. Qобр.-52,31 0 393,5 285,6 кДж\моль обр. реакции =Σ 2Qобр.-52,31 0 393,5 285,6 кДж\моль обр.(I) = Ar(I)/Mr(в-ва) CO2) +2Qобр.-52,31 0 393,5 285,6 кДж\моль обр.(I) = Ar(I)/Mr(в-ва)H2O) - Σ Qобр.-52,31 0 393,5 285,6 кДж\моль обр(I) = Ar(I)/Mr(в-ва)C2H4) Qобр.-52,31 0 393,5 285,6 кДж\моль обр. реакции = 2(I) = Ar(I)/Mr(в-ва)393,5)+ 2(I) = Ar(I)/Mr(в-ва)285,6) – (I) = Ar(I)/Mr(в-ва)-52,31) = 1410,51 кДж\моль 3. n (I) = Ar(I)/Mr(в-ва)С2H4) = V\Vm =50 (I) = Ar(I)/Mr(в-ва)л) \22,4 (I) = Ar(I)/Mr(в-ва)л\моль)=2,23(I) = Ar(I)/Mr(в-ва)моль) 4. Qобр.-52,31 0 393,5 285,6 кДж\моль= 2,23(I) = Ar(I)/Mr(в-ва)моль) *1410,51 (I) = Ar(I)/Mr(в-ва)кДж\моль) \ 1(I) = Ar(I)/Mr(в-ва)моль) = 3145,4 кДж\моль 5. Отв.: 3145,4 кДж\моль








 5.0
5.0 5.0
5.0 5.0
5.0 5.0
5.0 4.0
4.0 5.0
5.0 5.0
5.0