Презентация и разработка по химии по теме "Щелочные металлы"
Конспект урока по теме: Щелочные металлы
МОУ СОШ №5, г. Егорьевск
Учиетель: Е.А. Семенова
Конспект урока по теме: Щелочные металлы
Цели урока:
Опираясь на знания учащихся об общих свойствах металлов, конкретизировать знания учащихся о свойствах металлов IА группы.
Познакомить учащихся со способом качественного распознавания ионов щелочных металлов и их соединений, с применением соединений щелочных металлов.
Продолжить формировать умения давать характеристику элемента по его положению в периодической системе химических элементов Д.И. Менделеева, на основе строения атома объяснять физические и химические свойства металлов, прогнозировать их применение.
Задачи урока:
Образовательные:
Сформировать знания о строении атома и свойствах щелочных металлов;
Совершенствовать экспериментальные умения и навыков учащихся.
Развивающие:
Сформировать навыки анализа и сопоставления известных химических фактов.
Совершенствовать умения логически мыслить.
Развить умения обобщать и делать правильные выводы из изученного материала.
Продолжить развитие умений переносить знания в новые ситуации и устанавливать межпредметные связи.
Воспитательные:
Создать условия для воспитания желания активно учиться, с интересом, без принуждения и перегрузок.
Продолжить развитие речевых навыков.
Продолжить развитие наблюдательности и умения делать выводы на основе наблюдаемого интереса к предмету и представлений.
Выработка положительной мотивации учения, чувства ответственности и уверенности в себе.
Оборудование и реактивы: литий металлический, стакан, вода, раствор фенолфталеина, фильтровальная бумага, компьютер, проектор, презентация Power Point.
Ход урока:
Организационный момент.
Актуализация знаний:
К сегодняшнему уроку Вам необходимо было повторить основные свойства и получение металлов, с которыми мы познакомились на предыдущих уроках.
Металлы – один из самых распространенных материалов, используемые цивилизацией на протяжении практически всей ее истории. Многие ученые восхищались этими элементами и их соединениями.
На интерактивной доске (слайд 1) зашифрована фамилия знаменитого русского ученого, который сказал: «Металлом называется светлое тело, которое ковать можно». Давайте отгадаем фамилию этого ученого, вспомнив чемпионов среди металлов по тем или иным физическим свойствам:
- Самый тугоплавкий металл – ответ: вольфрам
- Самый распространенный на Земле – ответ: алюминий
- Самый легкий – ответ: литий
- Самый электропроводный – ответ: серебро
- Самый твердый – ответ: хром
- Самый пластичный – ответ: золото
- Самый легкоплавкий – ответ: ртуть
- Самый тяжелый – ответ: осмий
- Самый космический – ответ: железо (в природе очень редко самородное железо, его происхождение считают метеоритным, т.е. космическим, а не земным)
Таким образом, вспомнив важнейшие физические свойства металлов, мы отгадали фамилию русского ученого, который сказал, что «Металлом называется светлое тело, которое можно ковать». Это М. Ломоносов.
Сегодня мы продолжим наше знакомство с металлами и более подробно рассмотрим элементы 1 группы главной подгруппы.
Записываем тему нашего урока: «Щелочные металлы» (cлайд 3)
Раскрываются цели урока. (слайд 4)
3. Объяснение нового материала
Кто они – щелочные металлы? Учащиеся слушают рассказ учителя (слайд 5)
Щелочны́е мета́ллы — это элементы I группы главной подгруппы. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов.
▪ Общая характеристика щелочных металлов по их положению в таблице (слайд 6)
Учащиеся вместе с учителем дают общую характеристику щелочных металлов по их положению в Периодической системе химических элементов.
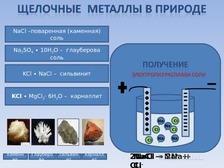
▪ Нахождение в природе (слайд 7)
Если посмотреть на ряд активности металлов, то можно увидеть, что щелочные металлы находятся в самом начале, т.е. эти металлы очень активные. В связи с этим в природе щелочные металлы встречаются только в виде соединений. Соединения натрия и калия очень распространены в природе, соединения лития, рубидия и цезия – редкие. Наиболее распространенные и важные соединения натрия и калия это:
- NaCl – поваренная соль
- Na2SO4 ∙ 10H2O - десятиводный кристаллогидрат (декагидрат) сульфата натрия.
- KCl · NaCl - осадочная горная порода, состоящая из чередующихся слоев галита и сильвина.
- KCl·MgCl2·6H2O - минерал, представляющий собой двойную соль хлорида калия и хлорида магния
▪ Получение щелочных металлов (слайд 7)
Итак, в самородном виде щелочные металлы в природе не встречаются, как же их получают? Щелочные металлы получают методом электролиза расплавов их солей. Например, натрий получают электролизом расплава его хлорида.
В расплавленном состоянии хлорид натрия представляет собой отрицательно заряженные хлорид-ионы и положительно заряженные ионы натрия. Хлорид-ионы, анионы, в электрическом поле передвигаются в сторону положительного электрода – анода, на котором они отдают электроны и превращаются далее в молекулярный хлор, который и выделяется из электролизера: В электрическом поле ионы натрия, катионы, передвигаются к отрицательному электроду – катоду, на котором происходит разряжение ионов и образование жидкого металлического натрия:
Таким образом получают щелочные металлы, а как же они выглядят. Рассмотрим физические свойства щелочных металлов.
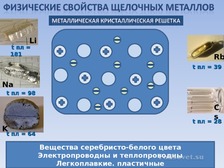
▪ Физические свойства щелочных металлов (слайд 8)
Для щелочных металлов, как и для других металлов характерна металлическая кристаллическая решетка. В узлах такой решётки находятся атомы и ионы, между которыми свободно перемещаются электроны, связывая их в единое целое.
Такое внутреннее строение металлов и определяет их физические свойства.
Щелочные металлы – вещества серебристого цвета, тепло и электропроводны. Франций – радиоактивный металл, период полураспада самого долгоживущего изотопа 22 минуты. Щелочные металлы легко режутся ножом.
Демонстрация: разрезание кусочка лития ножом.
▪ Химические свойства щелочных металлов (слайд 9)
У атомов щелочных металлов большой атомный радиус, а на внешнем энергетическом уровне находится 1 электрон. Поэтому щелочные металлы в реакциях стремятся отдавать свой электрон, проявляя свойства восстановителей. Щелочные металлы очень активны
Щелочные металлы вследствие их высокой активности хранят в толстостенных сосудах из темного стекла под слоем керосина. Литий из-за его малой плотности хранят под слоем вазелинового масла.
1. Взаимодействие с простыми веществами:
4 Li + O2 → 2 Li2O (натрий образует пероксид, а калий надпероксид)
6 Li + N2→ 2 Li3N (литий в присутствии влаги реагирует при комнатной температуре с азотом воздуха, забегая вперед, скажу, что азот воздуха химически инертен и при комнатной температуре реагирует только с литием)
2. Взаимодействие со сложными веществами
Демонстрация: Взаимодействие лития с водой.
2Li + 2H2O → 2LiOH + H2
LiOH + ф. фт. → малиновый раствор
Литий реагирует с водой спокойно, другие же щелочные металлы реагируют более бурно, натрий – воспламеняется, а калий взрывается.
Качественная реакция на ионы щелочных металлов: окраска пламени
▪ Биологическая роль и применение соединений калия (слайд 10)
Поташ (К2СО3) – используют для получения жидкого мыла, в с/х в качестве хорошего удобрения. В настоящее время – зарегистрирован как добавка к пище Е 501 (регулятор кислотности).
Калийная селитра (КNO3) – используют в пиротехнике как окислитель
Глауберова соль - используют в стекольном производстве, в стиральных порошках, зарегистрирован, как пищевая дабавка Е 514 – регулятор кислотности
▪ Закрепление изученного материала: Учащиеся выполняют задание по карте урока и затем вместе с учителем проверяют на доске (слайд 11).
▪ Домашнее задание: (слайд 12)
▪ Подведение итогов урока.
На странице приведен фрагмент.
|
Автор: Семенова Елена Анатольевна
→ lenok7839 |
Спасибо за Вашу оценку. Если хотите, чтобы Ваше имя
стало известно автору, войдите на сайт как пользователь
и нажмите Спасибо еще раз. Ваше имя появится на этой стрнице.