Урок химии по теме "Бериллий, магний и щелочноземельные металлы",9 класс
Бериллий, магний и щелочноземельные металлы
Цель: дать общую характеристику металлов главной подгруппы II группы. Рассмотреть основные физические и химические свойства этих элементов
Ход урока
Орг момент
Проверка умений и навыков
Генетические ряды:
LiOH ←Li →Li2O →LiOH→LiCl
↓
LiCl
Na→Na2O2→Na2O→NaOH→Na2SO4
↓
Na3PO4
Беседа по вопросам:
- Что общего в строении атомов ЩМ?
- Как меняются восстановительные свойства ЩМ в группе?
- Почему ЩМ хранят под слоем керосина?
- Перечислить физические свойства ЩМ.
- Как получают ЩМ?
- Перечислить основные химические свойства ЩМ.
- Какой характер имеют оксиды ЩМ?
- В какой цвет окрашиваю пламя соли лития, натрия, калия?
3. Изучение нового материала
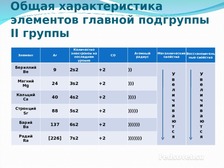
Общая характеристика элементов главной подгруппы II группы
|
Элемент |
Ar |
Количество электронов на последнем уровне |
СО |
Атомный радиус |
Металлические свойства |
Восстановительные свойства |
|
Бериллий |
9 |
2s2 |
+2 |
)) |
|
|
|
Магний |
24 |
3s2 |
+2 |
))) |
||
|
Кальций |
40 |
4s2 |
+2 |
)))) |
||
|
Стронций |
88 |
5s2 |
+2 |
))))) |
||
|
Барий |
137 |
6s2 |
+2 |
)))))) |
||
|
Радий |
[226] |
7s2 |
+2 |
))))))) |
К щелочноземельным металлам относят : Ca, Sr, Ba, Ra
Ве - амфотерный металл, Mg – металл, Сa, Sr,Ba - щёлочноземельные металлы Ra –радиоактивный элемент
- Общим является одинаковое строение внешнего электронного слоя
- Элементы проявляют СО +2
- Атомы элементов являются сильными восстановителями, т.к содержат 2 электрона на внешнем энергетическом уровне, которые отдают при взаимодействиями с другими элементами.
- С увеличением № элементов увеличивается атомный радиус, увеличивается число электронных слоев, следовательно возрастает легкость отдачи электронов. Восстановительные свойства увеличиваются в группе сверху вниз.
- Mg хранится на воздухе, ЩЗМ под слоем керосина.
Физические свойства.
Be – светло-серый, твердый, хрупкий металл
Mg – относительно мягкий, пластичный, ковкий
Ca – твердый, пластичный
Sr – ковкий
Ba - пластичный, ковкий
Химические свойства элементов II группы главной подгруппы
|
1.С кислородом
|
2M+O2=2MO (оксид) |
|
2.С галогенами
|
M+Cl2=MCl2 (хлорид) |
|
3.С серой
|
M+S=MS (сульфид) |
|
4.С азотом
|
3M+N2=M3N2 (нитрид) |
|
5.С водородом
|
M+H2=MH2 (гидрид) |
|
6.С водой |
M+2H2O=M(OH)2+H2 |
Химические свойства оксидов и гидроксидов
BeO – амфотерный оксид
M gO
CaO
SrO Основные оксиды
BaO
CaO +H2O → Ca(OH)2
По таблице растворимости определить растворимость гидроксидов:
Ве(ОН)2 – амфотерный гидроксид
Mg(OH)2 – нерастворимое основание
Ca(OH)2
Sr(OH)2 - растворимые основания (щелочи)
Ba(OH)2
Генетические ряды
Са(ОН)2 ←Са→СаО→Са(ОН)2→Са(NO3)2→CaSO4
Be→BeO→BeCl2→Be(OH)2→Na2BeO2
↓
BeSO4
Домашнее задание
§12, упр 5
На странице приведен фрагмент.
|
Автор: Князева Ольга Александровна
→ ОльгаКн |
Спасибо за Вашу оценку. Если хотите, чтобы Ваше имя
стало известно автору, войдите на сайт как пользователь
и нажмите Спасибо еще раз. Ваше имя появится на этой стрнице.