Слайд 1
Окислительновосстановительные реакции в органической химии «Кто-то теряет, то находит...» а кто-

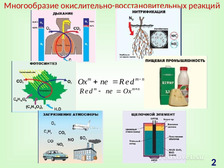
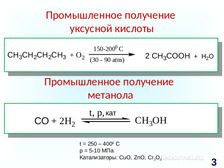
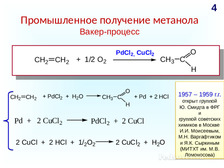
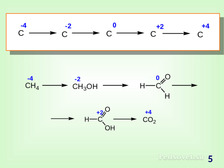
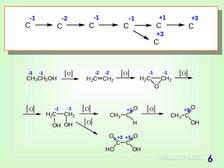
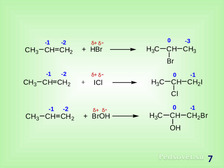

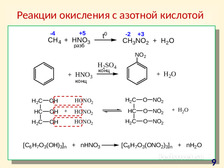
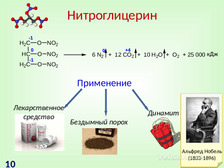



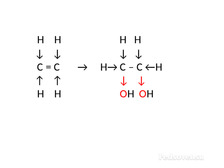


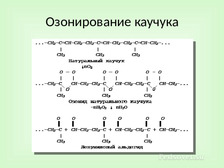
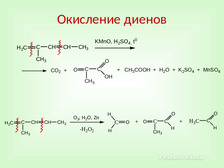
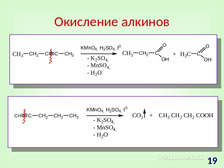
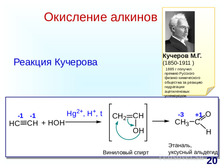
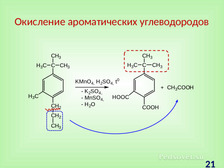
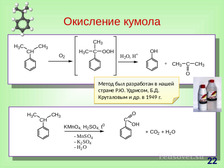
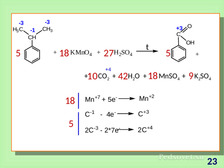
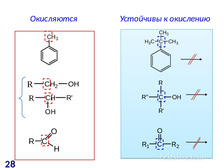
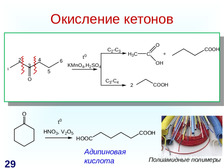
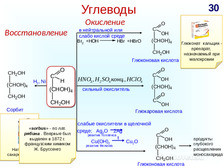
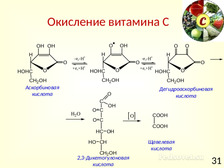

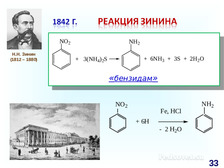
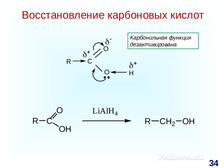
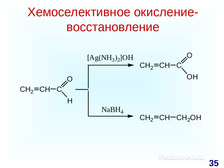

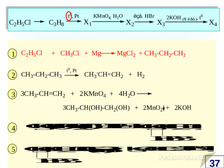
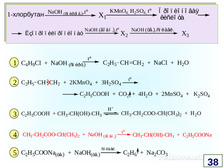
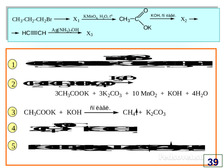
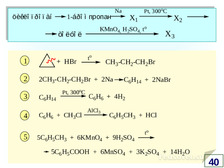
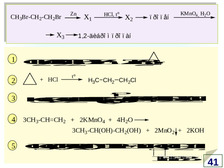
|
Автор: Целиковская Елена Викторовна
→ Публикатор |
Спасибо за Вашу оценку. Если хотите, чтобы Ваше имя
стало известно автору, войдите на сайт как пользователь
и нажмите Спасибо еще раз. Ваше имя появится на этой стрнице.

Есть мнение?
Оставьте комментарий