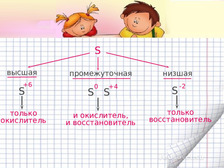
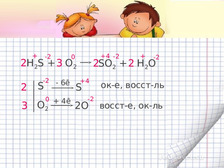Презентация к уроку химии "Окислительно-восстановительные реакции"
На странице приведен фрагмент.
|
Автор: Кольцова Ирина Аркадьевна
→ Публикатор |
Спасибо за Вашу оценку. Если хотите, чтобы Ваше имя
стало известно автору, войдите на сайт как пользователь
и нажмите Спасибо еще раз. Ваше имя появится на этой стрнице.
А вы знали?
Инструкции по ПК