Слайд 1
Гидролиз солей.
Единственный путь,
Ведущий к знанию,Это деятельность.
«Шоу»
Составила Громова Ольга Ильинична, учитель химии и биологии
«МОУ Лямбирская СОШ № 1»







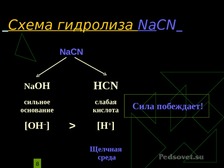

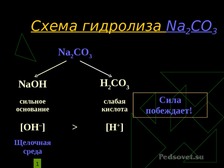

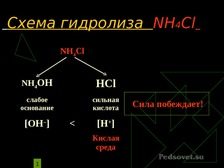

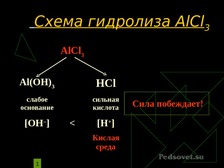

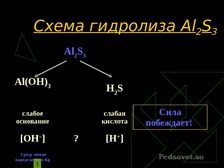

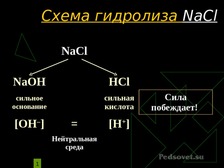




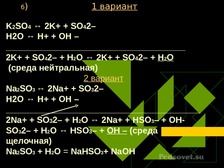







|
Автор: Громова Ольга Ильинична
→ бромик |
Спасибо за Вашу оценку. Если хотите, чтобы Ваше имя
стало известно автору, войдите на сайт как пользователь
и нажмите Спасибо еще раз. Ваше имя появится на этой стрнице.

Есть мнение?
Оставьте комментарий