Презентация к уроку химии "Сера"

Слайд 2
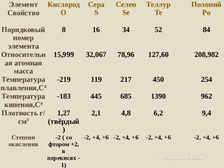
Элемент Свойство Кислород O Сера S Порядковый 8 16 номер элемента Относительн 15,999 32,067 ая атомная масса Температура -219 119 плавления,С0 Температура -183 445 кипения,С0 Плотность г/ 1,27 2,1 см3 (твёрдый ) Степени окисления Селен Se Теллур Te Полоний Po 34 52 84 78,96 127,60 208,982 217 450 254 685 1390 962 4,8 6,2 9,4 -2, +4, +6 -2, +4, +6 -2 ( со -2, +4, +6 -2, +4, +6 фтором +2, в перекисях 1)

Слайд 3
Строение атома Электронная формула O +8 )2)6 1s22s22p4 S +16 )2)8)6 1s22s22p63s23p4 Se +34 )2)8)18)6 1s22s22p63s23p63d104s24p4 Te +52 )2)8)18)18)6 1s22s22p63s23p63d104s24p64d105s25p4 Po +84 )2)8)18)32)18)6 1s22s22p63s23p63d104s24p64d104f145s2 5p65d106s26p4 Общая формула строения внешнего уровня ns2np4 Это p – элементы.p p – элементы.– элементы. На внешнем уровне 6 валентных электронов. Внешний уровень незавершённый.

Слайд 4
Строение атома кислорода O+8)2)6 1s22s22p4 P - элемент Строение атома серы S+16)2)8)6 1s22s22p63s23p4 P - элемент Кислород и сера имеют одинаковое строение внешнего энергетического уровня – p – элементы.ns2np4, p – элементы.где p – элементы.n p – элементы.– номер периода.
Слайд 5
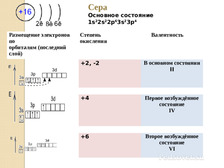
Сера Основное состояние 1s22s22p63s23p4 Размещение электронов по орбиталям (последний слой) Степень окисления Валентность +2, -2 В основном состоянии II +4 Первое возбуждённое состояние IV +6 Второе возбуждённое состояние VI

Слайд 6
Валентности p – элементы.(II, IV, VI), исключение, атом кислорода (валентность p – элементы.II). Высшие оксиды состава p – элементы.RO3 (здесь элемент p – элементы.R p – элементы.проявляет высшую валентность p – элементы.= номеру группы = p – элементы.VI) Летучие водородные соединения состава p – элементы.H2R p – элементы.водные растворы которых являются кислотами (здесь элемент проявляет низшую валентность = 8 – p – элементы.Nгруппы p – элементы.= p – элементы.II)

Слайд 7
Аллотропия серы Ромбическая (a - сера) - Sсера) - S) сера) - S- S8 t°пл. = сера) - S113°C; ρ = сера) - S2,07 сера) - Sг/см3. На) - Sиболее сера) - Sустойчива) - Sя сера) - Sмодифика) - Sция Моноклинная (b - сера) - Sсера) - S) сера) - S- S8 темно-желтые сера) - Sиглы, t°пл. = сера) - S119°C; ρ = сера) - S1,96 сера) - Sг/см3. сера) - SУстойчива) - Sя сера) - S при сера) - Sтемпера) - Sтуре сера) - Sболее 96°С; сера) - Sпри сера) - S обычных сера) - Sусловиях сера) - Sпревра) - Sща) - Sется сера) - Sв сера) - S ромбическую. Пластическая Sn коричнева) - Sя сера) - Sрезиноподобна) - Sя сера) - S (а) - Sморфна) - Sя) сера) - Sма) - Sсса) - S. Неустойчива) - S, сера) - S при сера) - Sза) - Sтвердева) - Sнии сера) - Sпревра) - Sща) - Sется сера) - S в сера) - Sромбическую.

Слайд 8
Нахождение в природе серы Самородная сера Поволжье Сульфиды PbS p – элементы.- свинцовый блеск Cu2S p – элементы.– медный блеск ZnS p – элементы.– цинковая обманка FeS2 p – элементы.– пирит, серный колчедан, кошачье золото H2S p – элементы.– сероводород (в минеральных источниках и природном газе) Белки Волосы, кожные покровы, ногти… Сульфаты CaSO4 p – элементы.x p – элементы.2H2O p – элементы.- гипс MgSO4 p – элементы.x p – элементы.7H2O p – элементы.– горькая соль (английская)

Слайд 9
Физические свойства Твердое кристаллическое вещество p – элементы.желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), p – элементы.t°кип p – элементы.= 445°С

Слайд 10
Получение серы 1. p – элементы. p – элементы. p – элементы. p – элементы. p – элементы. Промышленный метод - выплавление из руды с помощью водяного пара. 2. p – элементы. p – элементы. p – элементы. p – элементы. p – элементы. Неполное окисление сероводорода (при недостатке кислорода). 2H2S + O2 p – элементы.= p – элементы.2S + 2H2O 3. p – элементы. p – элементы. p – элементы. p – элементы. p – элементы. Реакция Вакенродера 2H2S p – элементы.+ p – элементы.SO2 p – элементы.= 3S p – элементы.+ 2H2O

Слайд 11
Применение Вулканизация каучука получение эбонита производство спичек пороха в борьбе с вредителями сельского хозяйства для медицинских целей (серные мази для лечения кожных заболеваний) для получения серной кислоты и т.д.

Слайд 12
Химические свойства серы Сера) - S сера) - S- сера) - Sокислитель S0 + сера) - S2ē сера) - S-> сера) - SS-2 Сера) - S - восста) - Sновитель S сера) - S- сера) - S2ē -> S+2; сера) - SS сера) - S- сера) - S4ē -> S+4; сера) - SS сера) - S- сера) - S6ē > S+6 1) c сера) - Sкислородом: S сера) - S+ сера) - SO2 сера) - S–t°-> сера) - SS+4O2 1) сера) - SСера) - S сера) - Sреа) - Sгирует сера) - Sсо сера) - S щелочными сера) - Sмета) - Sлла) - Sми сера) - Sбез сера) - S на) - Sгрева) - Sния: 2S + сера) - S3O2 –t°;pt-> 2S+6O3 2Na + S -> Na2S 2) c га) - Sлогена) - Sми сера) - S(кроме сера) - Sйода) - S): c оста) - Sльными сера) - Sмета) - Sлла) - Sми сера) - S S + Cl2 -> S+2Cl2 (кроме Au, Pt) сера) - S- сера) - Sпри сера) - S 3) c кислота) - Sми сера) - S- сера) - S повышенной t°: окислителями: 2Al сера) - S+ сера) - S3S сера) - S сера) - S сера) - S сера) - S->t° Al2S3 S сера) - S+ сера) - S2H2SO4(конц) -> 3S+4O2 + сера) - S t° сера) - S сера) - S сера) - S сера) - S сера) - S сера) - SZn сера) - S+ сера) - SS сера) - S сера) - S сера) - S сера) - S-> сера) - S сера) - S ZnS 2H2O Cu сера) - S+ сера) - SS -> сера) - St° CuS S сера) - S+ сера) - S6HNO (конц) -> H S+6O + сера) - S 3 2 4 6NO2 + сера) - S2H2O 2) сера) - SС сера) - Sнекоторыми сера) - S немета) - Sлла) - Sми сера) - Sсера) - S сера) - Sобра) - Sзует сера) - S Реакции диспропорционирования: бина) - Sрные сера) - Sсоединения: 4) 3S0 + сера) - S6KOH -> K2S+4O3 + сера) - S2K2SH2 + сера) - SS -> H2S 2 + сера) - S3H2O 2P сера) - S+ сера) - S3S -> P S 2 3

Слайд 13
Домашняя работа. Отчет по ПР 2( в тетради для практических работ) ЗАДАНИЯ ( в рабочей тетради) №1. Закончите уравнения реакций: S + O2 S + Na S + H2 Расставьте коэффициенты №2. Осуществите превращения по схеме: H2S → S → Al2S3 p – элементы.→ Al(OH)3 №3. p – элементы.Закончите уравнения реакций Al p – элементы.+ p – элементы.S p – элементы.= p – элементы. p – элементы.(при нагревании) S p – элементы.+ p – элементы.H2 p – элементы.= (150-200) S p – элементы.+ p – элементы.O2 p – элементы.= (при нагревании) S p – элементы.+ p – элементы.F2 p – элементы.= p – элементы. p – элементы.(при обычных условиях) S + H2SO4(к) = S + KOH = S + HNO3 p – элементы.=
На странице приведен фрагмент.
|
Автор: Саитова Арюзат Кожовна
→ Публикатор |
Спасибо за Вашу оценку. Если хотите, чтобы Ваше имя
стало известно автору, войдите на сайт как пользователь
и нажмите Спасибо еще раз. Ваше имя появится на этой стрнице.

Есть мнение?
Оставьте комментарий
А вы знали?
Инструкции по ПК